Растительные полифенолы как эпигенетические модуляторы

Считается, что термин «эпигенетика» был впервые предложен Conrad Hal Waddington (1905-1975) в 1942 году. Он определил эпигенетику как отрасль биологии, изучающая причинные взаимодействия между генами и их продуктами, которые отвечают за фенотип организма [1]. Позже, в 1987 году, Robin Holliday пересмотрел эпигенетику как вариант ядерного наследования не основаный на различиях в последовательности ДНК [2]. На сегодняшний день принято, что эпигенетика исследует наследственные изменения в регуляции гена без изменения последовательности ДНК, с учетом того, что эти изменения могут происходить по всему геному. В отличие от генетических изменений эпигенетические модификации обратимы. Эпигенетическое наследование теперь признано критически важным механизмом в регуляции генов участвующих во всех биологических процессах и клеточной памяти. Достаточно хорошо описаны молекулярные механизмы эпигенетических модификаций, включая ДНК метилирование, модификацию гистонов и микроРНК. К настоящему времени понятно, что эпигенетические модификации играют решающую роль в паттернах развития физиологических и патофизиологических процессов [3]. По сравнению с генетическими изменениями эпигенетические изменения считаются самыми ранними и наиболее обратимыми, а в связи с этим, представляющие интересные новые цели для вмешательства в течение болезни эффективность терапии.
Среди эпигенетических модификаций метилирование ДНК, вероятно, является наиболее часто описываемой эпигенетической модификацией. Метилирование происходит на цитозиновом остатке CpG-динуклеотидов, в котором за цитозином (5') следует гуаниновый остаток (3'). ДНК-метилирование обычно связано с инактивацией гена [4]. ДНК-метилирование вызывает подавление генов путем предотвращения или содействия рекрутированию регуляторных белков в ДНК. Например, этот процесс может ингибировать связывание определенных факторов транскрипции или может обеспечивать сайты связывания для белков, которые опосредуют репрессию генов посредством взаимодействия с гистондезацетилазами (HDAC) [5]. Также сообщается, что парадоксальным образом, метилирование ДНК сайтов связывания фактора транскрипции может ингибировать связывание репрессорных белков, что может привести к индуцированию активации гена [6]. В целом, метилирование повторяющихся последовательностей ДНК способствует хромосомной стабильности. Сообщалось о тканевой специфической метилировании ДНК в разных соматических тканях. Здесь метилирование играет важную роль в регуляции важных для развития организма генов [7].
Гистонные модификации. Гистоновые белки в эукариотических ядрах играют центральную роль в упаковке ДНК в плотную структуру хроматина. Поэтому белки гистона играют решающую роль в экспрессии генов, регулируя доступность специфических факторов транскрипции к ДНК. N-концевые хвосты гистонов подвергаются целому ряду посттрансляционных ковалентных модификаций, включая фосфорилирование, метилирование, ацетилирование, убиквитилирование, гликозилирование и сумоилирование, которые регулируют ключевые клеточные процессы, включая экспрессию генов. Ацетилирование, вероятно, является наиболее широко изученной модификацией гистонов. Предполагают, что активация или регенерация гена зависит от типов модификаций гистонов, например, в то время как ацетилирование лизина связано с активацией транскрипции, метилирование этой аминокислоты может индуцировать или подавлять экспрессию гена. Например, триметилирование лизина 4 на гистоне H3 (H3K4me3) связано с активацией гена, тогда как аналогичная модификация H3K9 (H3K9me3) и H3K27 (H3K27me3) связана с подавлением транскрипции [8]. Фосфорилирование гистонов в основном связано с транскрипцией гена [9].
Помимо вышеуказанных модификаций, в качестве важного компонента, рассматриваются и эпигенетические изменения микроРНК (miRNA), которые участвуют в модификации генов после трансляции. miRNA представляют собой класс небольших (приблизительно 22 нуклеотида в длину) некодирующих РНК, регулирующих экспрессию генов. Это происходит посредством спаривания оснований между miRNA и мРНК (ма́тричная рибонуклеи́новая кислота́) и приводит к последующей деградации мРНК или трансляционной репрессии [10]. Сегодня известно более 1000 человеческих miRNA -последовательностей [11]. Предполагается, что более трети человеческих генов регулируются miRNAs [12]. Некодирующая РНК имеет важное значение для нормальных клеточных процессов (например, интронов и сплайсинга); однако аберрантные образцы экспрессии miRNA связаны с хромосомной нестабильностью [13].
Постоянно растет количество доказательств, демонстрирующих, что эпигенетические процессы модулируются компонентами диеты, в частности полифенолами и алкалоидами, присутствующими в пище. Полифенолы являются уникальным семейством вторичных метаболитов, присутствующих в листьев, коре, овощах, фруктах, травах и многих высших растениях. Oни являются наиболее распространенными биоактивными натуральными продуктами и участвуют в химической защите растений, а также играют важную роль в воспроизводстве и росте растений.
Понятно, что к полифенолам относят водорастворимые соединения, которые обладают несколькими фенольными группами (обычно от 12 до 16 фенольных гидроксильных групп). Они имеют молекулярные массы в диапазоне 500-5000 Да и содержат от 5 до 7 ароматических колец [14]. Основываясь на их общей структуре, полифенолы можно разделить, по меньшей мере, на десять различных классов, таких как фенольные кислоты и производные, флавоноиды, стилбены, кумарины, танины и др. [15]. Все они демонстрируют широкий спектр биологической активности, включая антиоксидантную активность, антирадикальную, противовоспалительную, противораковую, противовирусную, антибактериальную, антитромбогенную, антиатерогенную активность [16]. Но, главное, - растительные полифенолы способны вызывать эпигенетические изменения. Здесь мы резюмируем и кратко обсудим роль основных групп полифенолов и возможности эпигенетических модуляций с их помощью при возраст-ассоциированных болезнях и при старении. Целью этой работы является обзор экспериментальных наблюдений, показывающих роль и механизмы, с помощью которых полифенолы участвуют в контроле метаболических процессов и модулируют эпигенетические пути, такие как метилирование ДНК, модификация гистонов и экспрессия miRNA. Надеемся, что в этом обзоре читатели увидят важнейшие проблемы, которые заслуживают будущих исследований.
В течение последних 6-10 лет во множестве были представлены экспериментальные исследования, демонстрирующие то, как воздействие питательных веществ, обозначаемых как нутриенты, может изменять экспрессию генов и изменять фенотип посредством эпигенетических модификаций. В свою очередь, для полифенолов, представляющих собой не эссенциальные компоненты пищи, в той или иной степени в эксперименте и клинике были описаны профилактические эффекты в отношении таких возраст-ассоциированных вариантов патологии, как рак, сердечно-сосудистые и метаболические заболевания, включая ожирение и диабет. Их позитивные эффекты обычно связывают с их способностью уменьшать уровень окислительного стресса, регулировать аутофагию и апоптоз, снижать активность ангиогенеза и рядом других доказанных или предполагаемых эффектов. Но эпигеном–регулирующая функция полифенолов, как функциональной части нутриентов, описана явно недостаточно. Мы для обзора выбрали молекулы, принадлежащие к наиболее представительным классам полифенолов, для того, чтобы показать широкий диапазон интерференции между полифенолами и эпигенетическими процессами.
Начнем описание с флавоноидов. Флавоноиды можно разделить на семь групп на основе различия в структуре кольца агликона C: флавоны, флаваноны, флавонолы, флаванонолы, изофлавоны, флаванолы (катехины) и антоцианидины.
Из флавонов имеются сведения относительно апигенина (4 ', 5,7-тригидроксифлавон), содержащегося в петрушке и сельдерее, предполагается, что этот полифенол является ингибитором ДНК-метилтрансферазы (DNMT) и гистон-диацетилазы (HDAC) [17], что обеспечивает глобальное ацетилирование гистона H3 и H4, а также повышенное ацетилирование гистона H3 в промоторе гена p21/waf1, сопровождающееся экспрессией p21 и стимуляцией апоптоза. Использование апигенина in vivo вызывает снижение роста опухоли предстательной железы [18]. Лютеолин - еще один флавон, присутствующий в тимьяне и других растениях, включая брюссельскую капусту, капусту, лук, брокколи и цветную капусту, проявляет заметную антиоксидантную и противовоспалительную активность [19]. Это также ингибитор DNMT in vitro и проявляет более сильную активность, чем апигенин при той же концентрации. В раковых клетках предстательной железы лютеолин препятствует экспрессии генов, участвующих в регуляции клеточного цикла [20].
Флавонолы. Кверцетин является флавонолом, обычно присутствует в луках, брокколи и листве зеленых овощей. Он также известен как мощный антиоксидант и противовоспалительный агент. Накопленные доказательства свидетельствует о том, что кверцетин проявляет противораковые эффекты путем модуляции эпигенетических механизмов. Так, кверцетин вызывает гибель клеток рака мочевого пузыря и, скорее всего, восстанавливает транскрипционную активность генов-супрессоров опухолей, приводящих к синтезу стимуляторов аутофагии [21]. При лейкемии кверцетин индуцирует апоптоз через путь ингибирования HDAC, в результате ацетилирования гистона [22,23]. Также кверцетин блокирует ген циклооксигеназы-2 (СОХ-2), уменьшает экспрессию в клетках рака молочной железы, снижает ангиогенез в эндогелии. Этот эффект обусловлен ингибированием кверцетином транс- активаторов, таких как CREB2 [24]. В клетках рака предстательной железы кверцетин индуцирует апоптоз путем деацетилирование гистона H3 [25]. Кроме того, кверцетин ингибирует TNF-индуцированные провоспалительные гены в мышиных эпителиальных клетках тонкой кишки [26,27].
Кемферол - еще один типичный флавонол, присутствующий в брокколи, чае и различных овощах. В клетках миелоидного лейкоза линии K562, обработанных каемпферолом установлено увеличение экспрессии в Sirt-3 и деацетилирование фтопротеина сукцинатдегидрогеназы (SdhA), субъединицы II митохондриального комплекса [28]. Мирицетин – это часто встречающийся в природе флавонол, найденный в винограде, ягодах, фруктах и овощах. Он ингибирует метилирование ДНК и имеет высокоаффинное взаимодействие с каталитическим сайтом DNMT человека [29].
Флаванолы зеленого чая, включая эпикатехин, эпигаллокатехин, эпикатехин-3-галлат и эпигаллокатехин-3-галлат (EGCG) ингибируют ДНК- метилирование, опосредуемое DNMT [30]. EGCG является самым распространенным полифенольным соединением в зеленом чае и, как известно, в наибольшей степени ингибирует DNMT. Обработка клеток EGCG приводит к снижению глобального гиполиметилирования ДНК, за счет активности DNMT. Эти эпигенетические изменения индуцированные EGCG впоследствии приводят к реактивации генов опухолевого супрессора p16INK4a и Cip1 / p21 [31]. В другом исследовании определно, что EGCG ингибирует пролиферацию клеток рака молочной железы и индуцирует апоптоз через понижающую регуляцию транскриптазы (hTERT) теломеразы человека, каталитической субъединицы, необходимой для правильного функционирования теломеразы. [32].
Антоцианидины - пигменты растений, которые придают красный и синий цвета и обычно встречаются во фруктах и овощах, таких как черника и виноград. Сообщается, что цианидин снижает TNF-индуцированный апоптоз в клетках. Исследования также показывают, что антоцианидины подавляют ацетилирование р53 и могут снижать р53-зависимую экспрессию апоптоза [33]. Дельфинидин - основной антоцианидин присутствующий в пигментированных фруктах и овощах, в синовиальных клетках при ревматоидном артрите у человека, ингибирует TNF-индуцированную активацию NF-B и экспрессию воспалительных генов [34].
Изофлавоны, такие как генистеин и дайдзеин из соевых бобов, являются подклассом флавоноидов, считающихся фитоэстрогенами также регулируют экспрессию генов, участвующих в эпигенетических модификация. Так изофлавоны восстанавливают экспрессию GSTP1 и EPHB2 (гены-супрессоры опухолей) путем деметилирования их промоторных областей [35-37].
Куркумин (диферулоилметан) является основным пигментом из корневища куркумы (Curcuma longa Linn). Куркумин идентифицирован как ингибитор DNMT и HAT in vitro. [38]. Существует много исследований, демонстрирующих, что противоопухолевое действие куркумина обусловлено таргетингом эпигенетической модификации DNMT, HAT и HDAC. Например, в андроген-зависимых и андроген-независимых клетках рака предстательной железы, куркумин тормозит рост и индуцирует апоптоз путем снижения регуляции экспрессии генов Bcl-2 и Bcl-XL за счет увеличения ацетилирования гистона H3 и H4, что приводит к регуляции транскрипция этих генов [39]. У трансгенных мышей с аденокарциномой предстательной железы куркумин реактивирует NF-E2-фактор 2 (Nrf2), который регулирует широкий спектр антиокислительных генов, восстанавливая метилирование ДНК Nrf2 промоутера [40,41]. Куркумин также ингибирует пролиферацию злокачественных гематологических клеток путем регуляции ацетилирования гистона H3 [42].
В нескольких исследованиях сообщается, что куркумин может улучшить хронические состояния и метаболические нарушения посредством эпигенетической модификации. У крыс Sprague-Dawley (SD) с помощью стрептозотоцина моделировали диабетическую нефропатию с повышенным содержанием мочевины и креатинина в моче, а также альбуминурией. На этой модели использование куркумин препятствует появлению диабетической нефропатии, что связывают с увеличением ацетилирования гистона H3 [43,44]. Также в миокардиоцитах куркумин оказывает защитное действие и может снизить избыточную экспрессию сердечных генов путем ацетилирования гистона H3 [45].
Ресвератрол (транс-3,5,4'-тригидроксистильбен) представляет собой соединение, находимое в основном в красном винограде. Это фитоалексин и антибиотическое вещество, используемое растениями для борьбы с грибковыми и бактериальными инфекциями. Ресвератрол уже давно признан чрезвычайно полезной субстанцией. Несколько исследований показывают, что ресвератрол способен восстанавливать глухие гены-супрессоры опухолей в клетках рака молочной железы путем реактивации экспрессии PTEN посредством уменьшения метилирования его промотора. Регулирование DNMT и повышение экспрессии гена p21 также наблюдается в клетках, обработанных ресвератролом [46,47]. У женщин с повышенным риском рака молочной железы, потребление 5 - 50 мг ресвератрола два раза в день в течение 12 недель коррелирует со сниженным метилированием RASSF1A, а также снижением уровня простагландина E2 (PGE2), что является проявлением механизма эпигенетической модуляции [48]. Ресвератрол также изменяет картину miRNA в клетках так, существует 71 miRNAs, которые регулируются ресвератролом [49,50].
Ресвератрол - известный активатор SIRT1, который является представителем высококонсервативных белковых деацетилаз. В настоящее время увеличивается количество доказательств того, что ресвератрол может улучшить исход ряда заболеваний, таких как нарушение обмена веществ, воспалительных и хронических заболеваний, а также может влиять на процессы старения путем повышения SIRT1. Ресвератрол оказывает нейропротекторное действие, видимо, путем ингибирования дофаминергического нейротоксина 1-метил-4-фенилпиридиния (MPP (+)). Кроме того, как ресвератрол, так и сиртуин является активатором NAD уменьшая действие N-метил-N'-нитро-N-нитрозогуанидина (МННГ) [51]. Кроме того, ресвератрол усиливает лейцин-опосредованную активацию AMP протеинкиназы (AMPK), Sirt1 и Sirt3 в адипоцитах и мышечных клетках, что повышает чувствительность к инсулину и уменьшает концентрацию воспалительных маркеров (CRP, IL-6, MCP-1, адипонектин), а также уменьшает ожирение и другие проявления метаболического синдрома [52].
Суммарные данные относительно эпигенетических механизмов действия основных представителей растительных полифенолов, присутствующих в пище, представлены в таблице 1.
Таблица 1.- Полифенолы, как эпигенетические регуляторы
|
Полифенол |
Источник |
Эпигенетический механизм |
Мишень в организме |
Ссылка |
||
|
Флавоны |
||||||
|
Апигенен, Гесперидин, Нарингин, Лютеолин |
Петрушка, сельдерей |
in vitro ингибитор ДНК-метилтрансферазы (DNMT). Ингибитор гистондезацетилазы (HDAC) и увеличение ацетилирования гистон H3 в промоторе p21 / waf1 Регулирование микроРНК-132 |
Рак простаты рак молочной железы |
7 |
||
|
Флавонолы |
||||||
|
Кверцетин |
Лук, брокколи |
Ингибитор DNMT . Уменьшает метилирование ДНК на рецепторе эстрогена (Erbeta), P16INK4a и RAS - семейство доменов ассоциации 1A (RASSF1A). Активация HAT и ингибирование HDAC. Угнетение HDAC-1 и DNMT1. Ингибирование cyclooxygenase-2 (COX-2). Повышение регуляции miRNA-146a Регуляция аутофагии. |
Рак простаты, рак молочной железы, Лейкемия, Рак мочевого пузыря. Воспаление кишечника, воспаление легких |
7 |
||
|
Кемферол |
Чай, брокколи |
Деацетилирование флавопротеина (SdhA) сукцинат дегидрогеназы путем регуляции Sirt3 |
Регуляция митохондриального метаболизма |
53 |
||
|
Эпикатехин |
Чай |
Ингибирование DNMT и ДНК-метилирование |
- |
7 |
||
|
Эпигаллокатехин ((EGCG)) |
Чай |
Ингибирование DNMT1. ДНК-метилирование. Регуляция теломеразы. Ингибирование HAT. Ингибирование гистон p300 ацетилтрансферазы (HAT). Регуляция аутофагии. |
Рак пищевода |
7 |
||
|
Aнтоцианидины |
||||||
|
Цианидин |
Черешня, вишня, клубника |
Ацетилирования p53 |
Уменьшение гибели эндотельных клеток |
53 |
||
|
Дельфиниум |
Темно-окрашенные фрукты |
Снижает активацию NF-B путем ингибирования p300 HAT |
Ревматоидный артрит |
|
||
|
Изофлавоны |
||||||
|
Дадзеин, Гинистеин |
Соя |
Реактивация RAR, p16INK4a и MGMT, ингибирование DNMT. Увеличение активности супрессоров генов опухоли путем уменьшения микроРНК-151 |
Рак простаты, рак молочной железы, рак толстой кишки, рак шейки матки меланома, нейробластома, рак почки. |
54 |
||
|
Куркумин |
Куркума |
Увеличение ацетилирования гистонов H3, H4 и гена р53. Уменьшает метилирование NF-E2. Снижение регуляции miRNA-186 Регуляция аутофагии. |
Рак простаты, рак шейки матки. Рак поджелудочной железы. Рак легких. Лейкемия. Глиома. Медуллобластома. Диабетическая нефропатия. Гипертрофия миокарда. |
55, 56 |
||
|
Ресвератрол |
Виноград и красное вино |
Уменьшает метилирование промоутеров генов: PTEN, RASSF1A, BRAC1, H3K9me3. Увеличение активности miRNA-663. Регуляция аутофагии.
|
Рак молочной железы, рак толстой кишки, немелкоклеточный рак легких. Нейродегенеративные состояния. Кардиоваскулярная дисфункция. Диабетическая кардиомиопатия. Почечные повреждения. Остеоартрит. Жировая дистрофия печени. Инсулинорезистентность. Ожирение. |
55,57, 58 |
||
|
Проантоцианидины. |
Фрукты, ягоды, фасоль, орехи, какао и вино. |
Понижение уровня miRNA-30b; Повышение miRNA-1224-3p, miRNA-197 и miRNA-532-3p. Регуляция аутофагии. |
Рак печение. Аденокарцинома пищевода. |
56 |
||
|
Проэпигаллокатехин галлат (Pro-EGCG) |
Зеленый чай |
Снижение регуляции эпигенетических модификаторов DNMT1, HDAC1, HDAC2 и G9a |
Хроническое воспаление, ингибиция пролиферации острой промиелоцитарной лейкемии |
59, 60 |
||
|
Комплекс полифенолов зеленого чая |
|
Уменьшение экспрессии miR-335 в жировой ткани, в адипоцитах Ингибирование DNMT1, UHRF1 и G9a, |
Ожирение, хроническое воспаление |
61,66 |
||
|
Комплекс полифенолов винограда |
Виноград и красное вино |
активация генов-супрессоров опухолей (TSG), восстановления или предотвращения эпигенетического молчания RASSF1A (ген Ras Association Family Family 1A) |
Рак легких |
62,65 |
||
|
Комплекс полифенолов черники или голубики |
Черника, голубика |
ингибитор метилирования для MTHFR (метилентетрагидрофолатредуктаза) и DNMT1 |
Антиоксидантная и антимутагенная активнсоть |
63 |
||
|
Комплекс полифенолов Hibiscus sabdariffa |
Hibiscus sabdariffa |
Модуляция гистон-ацетилтрансферазы, гистондезацилазы, ДНК-метилтрансферазы, киназы и miRNA |
Ожирение |
64 |
||
В целом вышеупомянутые исследования убедительно показывают, что полифенолы могут косвенно модулировать эпигеном, препятствуя специфическим эпигенетическим процессам, приводящим к изменениям хроматина, а также модификации и / или коррекции аберрантной экспрессии miRNA. Однако точные молекулярные механизмы эпигенетических изменений, инициируемых полифенолами, в значительной степени неизвестны и представляют собой приоритет для дальнейших исследований.
Следует учесть, что парадокс многих исследований in vitro, включенных в настоящий обзор, в том, что в этих работах использованы высокие концентрации агликонов полифенолов (до 100 мкМ), которые реально никогда не будут достигнуты после перорального введения или даже после внутривенной инъекции, в случае гипотетических терапевтических применений. Эти ограничения, очевидно, являются результатом двух общих признаков, касающихся почти всех полифенолов: недостаточная биодоступность и высокий уровень метаболизма. Фактически после абсорбции полифенолы сначала метаболизируются в клетках тонкой кишки, потом в печени, а затем и в других тканях. В результате, свободные агликоны, т.е. химические формы, обычно добавляемые к клеткам при исследовании in vitro, не обнаруживаются in vivo в кровотоке. Конечно, это вроде, логично, но с другой стороны, если это так, то как можно объяснить обнадеживающие результаты, о которых сообщается в нескольких клинических обзорах, например при использовании диеты на основе полифенолов для профилактики рака? [65]. В объяснение предлагаем две основные гипотезы: либо метаболиты и сопряженные формы полифенолов биологически активны, либо после поглощения клетками тканей метаболиты деконъюгируются внутриклеточно, регенерируя свободный активный агликон. Например, установлено, что такая деконъюгация кверцетина может происходить в печени, в фибробластах, в нейтрофилах человека [67, 68].
Вероятно, следующим и более важным шагом в исследовании полифенолов должно стать установление эффективных доз, профиля безопасности и оптимальной продолжительности применения полифенолов для того, чтобы оказывают благотворное влияние на человека.
Очевидно, существует необходимость более систематических исследований, направленных на выявление факторов, которые оказывают наибольшее влияние на результат взаимодействия полифенолов и эпигенома, необходимо понимание механизмов, через которые это происходит. Пока же, можно предложить очень условную схему, взятую из работы Min-Hsiung Pan и соавт [69] примитивно объясняющую эпигенетическое влияние полифенолов.
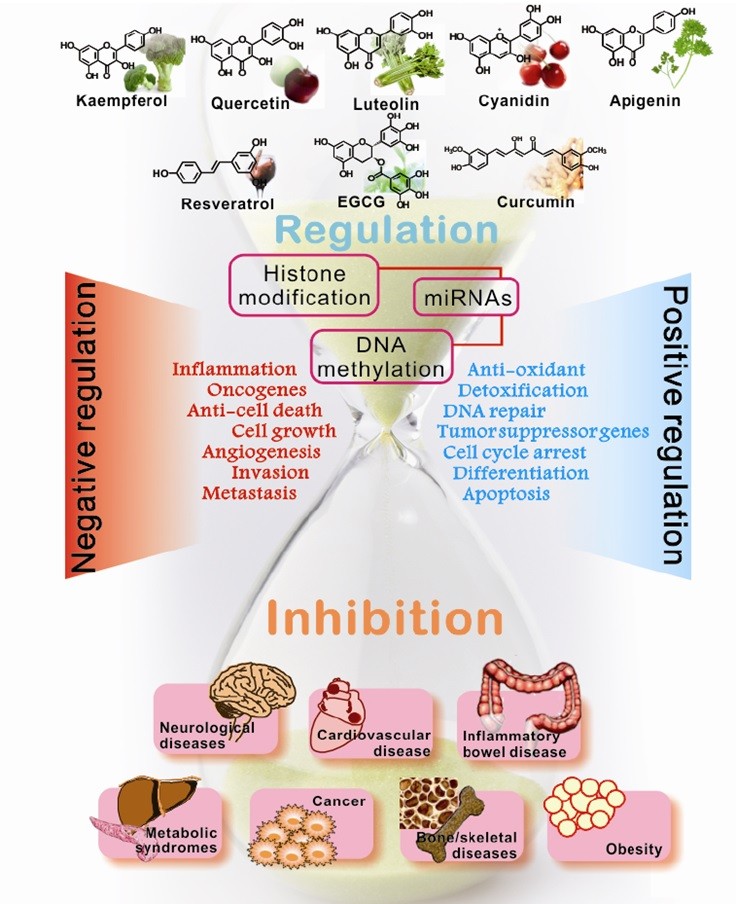
Рисунок 1 - Интегральная схема эпигенетических механизмов для полифенолов
Таким образом, эпигенетические механизмы регуляции могут представлять собой привлекательные точки для фармакологических исследований путей повышения шансов долгожительства, поскольку есть предположение о тесной связи эпигенетических механизмов с развитием возраст-ассоциированной патологии человека. Самое важное различие между генетическим и эпигенетическим статусом в том, что эпигенетические изменения обратимы, но генетические изменений обычно нет. Таким образом, эпигенетические изменения становятся привлекательными целями для лечения различных заболеваний. Можно утверждать, что полифенолы обладают потенциалом профилактики и лечения посредством регулирования эпигенома. Так, не лишено смысла предположение, что полифенолы могут помочь восстановить активность гена опухолевого супрессора, антиокислительных генов, генов репарации ДНК и снизить регуляцию онкогенных генов при прогрессировании клеточного цикла, пролиферации, инвазии, ангиогенез и метастазировании.
Надеемся, что будущие исследования представят новые доказательства эпигенетических эффектов полифенолов и предложат эффективные стратегии использования полифенолов в терапии и профилактике.
Литература
1. Waddington CH The epigenotype. Endeavour 1942; 1: 18-20. – цит по Min-Hsiung Pan et al. Epigenetic and Disease Targets by Polyphenols Current Pharmaceutical Design, 2013, 19, 1-25
2. Holliday R The inheritance of epigenetic defects. Science 1987; 238: 163-70.
3. Feinberg AP, Ohlsson R, Henikoff S The epigenetic progenitor origin of human cancer. Nat Rev Genet 2006; 7: 21-33.
4. Ho E, Beaver LM, Williams DE, Dashwood RH. Dietary factors and epigenetic regulation for prostate cancer prevention. Adv Nutr 2011;2:497-510.
5. Sharma S, Kelly TK, Jones PA. Epigenetics in cancer. Carcinogenesis 2010;31:27-36.
6. Vanden Berghe W. Epigenetic impact of dietary polyphenols in cancer chemoprevention: Lifelong remodeling of our epigenomes. Pharmacol Res 2012;65:565-76.
7. Bag A, Bag N. Tea polyphenols and prevention of epigenetic aberrations in cancer. J Nat Sc Biol Med 2018;9:2-5
8. Daniūnaitė K, Jarmalaitė S, Kriukienė E. Epigenomic technologies for deciphering circulating tumor DNA.Curr Opin Biotechnol. 2018 Aug 3;55:23-29.
9. Busch C, Burkard M, Leischner C, Lauer UM, Frank J, Venturelli S. Epigenetic activities of flavonoids in the prevention and treatment of cancer. Clin Epigenetics 2015;7:64.
10. Ross SA, Davis CD. MicroRNA, nutrition, and cancer prevention. Adv Nutr 2011;2:472-85
11. Zhang B, Unver T. A critical and speculative review on microRNA technology in crop improvement: Current challenges and future directions. Plant Sci. 2018 Sep;274:193-200
12. Lewis BP, Burge CB, Bartel DP. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets. Cell 2005;120:15-20
13. Ross SA, Davis CD. MicroRNA, nutrition, and cancer prevention. Adv Nutr 2011;2:472-85
14. Haslam E: E. Plant polyphenols. Vegetable tannins revisited, ed. Cambridge University Press: Cambridge, U. K., 1989.
15. Ferrazzano GF, Amato I, Ingenito A, et al. Plant polyphenols and their anti-cariogenic properties: a review. Molecules 2011; 16: 1486-507.
16. Pan MH, Ho CT Chemopreventive effects of natural dietary compounds on cancer development. Chem Soc Rev 2008; 37: 2558-74
17. Fang M, Chen D, Yang CS Dietary polyphenols may affect DNA methylation. J Nutr 2007; 137: 223S-8S.
18. Pandey M, Kaur P, Shukla S, et al. Plant flavone apigenin inhibits HDAC and remodels chromatin to induce growth arrest and apoptosis in human prostate cancer cells: In vitro and in vivo study. Mol Carcinog 2012; 51: 952-62.
19. Lin Y, Shi R, Wang X, et al. Luteolin, a flavonoid with potential for cancer prevention and therapy. Curr Cancer Drug Targets 2008; 8: 634-46.
20. Shoulars K, Rodriguez MA, Thompson T, et al. Regulation of cell cycle and RNA transcription genes identified by microarray analysis of PC-3 human prostate cancer cells treated with luteolin. J Steroid Biochem Mol Biol 2010; 118: 41-50.
21. Ma L, Feugang JM, Konarski P, et al. Growth inhibitory effects of quercetin on bladder cancer cell. Front Biosci 2006; 11: 2275-85.
22. Jia J, Chen J Histone hyperacetylation is involved in the quercetininduced human leukemia cell death. Pharmazie 2008; 63: 379-83.
23. Lee WJ, Chen YR, Tseng TH Quercetin induces FasL-related apoptosis, in part, through promotion of histone H3 acetylation in human leukemia HL-60 cells. Oncol Rep 2011; 25: 583-91.
24. Xiao X, Shi D, Liu L, et al. Quercetin suppresses cyclooxygenase-2 expression and angiogenesis through inactivation of P300 signaling. PLoS One 2011; 6: e22934.
25. Kim YH, Lee DH, Jeong JH, et al. Quercetin augments TRAILinduced apoptotic death: involvement of the ERK signal transduction pathway. Biochem Pharmacol 2008; 75: 1946-58.
26. Ruiz PA, Braune A, Holzlwimmer G, et al. Quercetin inhibits TNF-induced NF-kappaB transcription factor recruitment to proinflammatory gene promoters in murine intestinal epithelial cells. J Nutr 2007; 137: 1208-15.
27. Noratto GD, Kim Y, Talcott ST, et al. Flavonol-rich fractions of yaupon holly leaves (Ilex vomitoria, Aquifoliaceae) induce microRNA-146a and have anti-inflammatory and chemopreventive effects in intestinal myofibroblast CCD-18Co cells. Fitoterapia 2011; 82: 557-69.
28. Cimen H, Han MJ, Yang Y, et al. Regulation of succinate dehydrogenase activity by SIRT3 in mammalian mitochondria. Biochemistry 2010; 49: 304-11.
29. Lee WJ, Shim JY, Zhu BT Mechanisms for the inhibition of DNA methyltransferases by tea catechins and bioflavonoids. Mol Pharmacol 2005; 68: 1018-30.
30. Lee WJ, Shim JY, Zhu BT Mechanisms for the inhibition of DNA methyltransferases by tea catechins and bioflavonoids. Mol Pharmacol 2005; 68: 1018-30.
31. Nandakumar V, Vaid M, Katiyar SK (-)-Epigallocatechin-3-gallate reactivates silenced tumor suppressor genes, Cip1/p21 and p16INK4a, by reducing DNA methylation and increasing histones acetylation in human skin cancer cells. Carcinogenesis 2011; 32: 537-44
32. Berletch JB, Liu C, Love WK, et al. Epigenetic and genetic mechanisms contribute to telomerase inhibition by EGCG. J Cell Biochem 2008; 103: 509-19.
33. Xu JW, Ikeda K, Yamori Y Inhibitory effect of polyphenol cyanidin on TNF-alpha-induced apoptosis through multiple signaling pathways in endothelial cells. Atherosclerosis 2007; 193: 299-308.
34. Seong AR, Yoo JY, Choi K, et al. Delphinidin, a specific inhibitor of histone acetyltransferase, suppresses inflammatory signaling via prevention of NF-kappaB acetylation in fibroblast-like synoviocyte MH7A cells. Biochem Biophys Res Commun 2011; 410: 581-6.
35. Vardi A, Bosviel R, Rabiau N, et al. Soy phytoestrogens modify DNA methylation of GSTP1, RASSF1A, EPH2 and BRCA1 promoter in prostate cancer cells. In vivo 2010; 24: 393-400.
36. Adjakly M, Bosviel R, Rabiau N, et al. DNA methylation and soy phytoestrogens: quantitative study in DU-145 and PC-3 human prostate cancer cell lines. Epigenomics 2011; 3: 795-803.
37. Bosviel R, Dumollard E, Dechelotte P, et al. Can soy phytoestrogens decrease DNA methylation in BRCA1 and BRCA2 oncosuppressor genes in breast cancer? OMICS 2012; 16: 235-44.
38. Balasubramanyam K, Varier RA, Altaf M, et al. Curcumin, a novel p300/CREB-binding protein-specific inhibitor of acetyltransferase, represses the acetylation of histone/nonhistone proteins and histone acetyltransferase-dependent chromatin transcription. J Biol Chem 2004; 279: 51163-71.
39. Shankar S, Srivastava RK Involvement of Bcl-2 family members, phosphatidylinositol 3'-kinase/AKT and mitochondrial p53 in curcumin (diferulolylmethane)-induced apoptosis in prostate cancer. Int J Oncol 2007; 30: 905-18.
40. Jha AK, Nikbakht M, Parashar G, et al. Reversal of hypermethylation and reactivation of the RARbeta2 gene by natural compounds in cervical cancer cell lines. Folia Biol (Praha) 2010; 56: 195-200.
41. Parashar G, Parashar NC, Capalash N Curcumin causes promoter hypomethylation and increased expression of FANCF gene in SiHa cell line. Mol Cell Biochem 2012; 365: 29-35.
42. Hu J, Wang Y, Chen Y Curcumin-induced histone acetylation in malignant hematologic cells. J Huazhong Univ Sci Technolog Med Sci 2009; 29: 25-8.
43. Tikoo K, Meena RL, Kabra DG, et al. Change in post-translational modifications of histone H3, heat-shock protein-27 and MAP kinase p38 expression by curcumin in streptozotocin-induced type I diabetic nephropathy. Br J Pharmacol 2008; 153: 1225-31.
44. Li HL, Liu C, de CG, et al. Curcumin prevents and reverses murine cardiac hypertrophy. J Clin Invest 2008; 118: 879-93.
45. Wang L, Sun H, Pan B, et al. Inhibition of histone acetylation by curcumin reduces alcohol-induced expression of heart development-related transcription factors in cardiac progenitor cells. Biochem Biophys Res Commun 2012; 424: 593-6.
46. Stefanska B, Salame P, Bednarek A, et al. Comparative effects of retinoic acid, vitamin D and resveratrol alone and in combination with adenosine analogues on methylation and expression of phosphatase and tensin homologue tumour suppressor gene in breast cancer cells. Br J Nutr 2012; 107: 781-90.
47. Papoutsis AJ, Borg JL, Selmin OI, et al. BRCA-1 promoter hypermethylation and silencing induced by the aromatic hydrocarbon receptor-ligand TCDD are prevented by resveratrol in MCF-7 Cells. J Nutr Biochem 2012; 23: 1324-32.
48. Zhu W, Qin W, Zhang K, et al. Trans-resveratrol alters mammary promoter hypermethylation in women at increased risk for breast cancer. Nutr Cancer 2012; 64: 393-400.
49. Bae S, Lee EM, Cha HJ, et al. Resveratrol alters microRNA expression profiles in A549 human non-small cell lung cancer cells. Mol Cells 2011; 32: 243-9.
50. Han Z, Yang Q, Liu B, et al. MicroRNA-622 functions as a tumor suppressor by targeting K-Ras and enhancing the anticarcinogenic effect of resveratrol. Carcinogenesis 2012; 33: 131-9.
51. Okawara M, Katsuki H, Kurimoto E, et al. Resveratrol protects dopaminergic neurons in midbrain slice culture from multiple insults. Biochem Pharmacol 2007; 73: 550-60.
52. Bruckbauer A, Zemel MB, Thorpe T, et al. Synergistic effects of leucine and resveratrol on insulin sensitivity and fat metabolism in adipocytes and mice. Nutr Metab (Lond) 2012; 9: 77.
53. Abdul QA, Yu BP, Chung HY, Jung HA, Choi JS. Epigenetic modifications of gene expression by lifestyle and environment. Arch Pharm Res. 2017 Nov;40(11):1219-1237
54. Sundaram MK, Ansari MZ, Al Mutery A, Ashraf M, Nasab R, Rai S, Rais N, Hussain A. Genistein Induces Alterations of Epigenetic Modulatory Signatures in Human Cervical Cancer Cells. Anticancer Agents Med Chem. 2018;18(3):412-421
55. Khan MI, Rath S, Adhami VM, Mukhtar H. Targeting epigenome with dietary nutrients in cancer: Current advances and future challenges.Pharmacol Res. 2018 Mar;129:375-387
56. Kumar A, Rimando AM, Levenson AS. Resveratrol and pterostilbene as a microRNA-mediated chemopreventive and therapeutic strategy in prostate cancer. Ann N Y Acad Sci. 2017 Sep;1403(1):15-26
57. Ferraresi A, Phadngam S, Morani F, Galetto A, Alabiso O, Chiorino G, Isidoro C. Resveratrol inhibits IL-6-induced ovarian cancer cell migration through epigenetic up-regulation of autophagy. Mol Carcinog. 2017 Mar;56(3):1164-1181.
58. Kumar A, Rimando AM, Levenson AS. Resveratrol and pterostilbene as a microRNA-mediated chemopreventive and therapeutic strategy in prostate cancer. Ann N Y Acad Sci. 2017 Sep; 1403(1):15-26.
59. Li F, Wang Y, Li D, Chen Y, Qiao X, Fardous R, Lewandowski A, Liu J, Chan TH, Dou QP. Perspectives on the recent developments with green tea polyphenols in drug discovery. Expert Opin Drug Discov. 2018 Jul;13(7):643-660.
60. Borutinskaitė V, Virkšaitė A, Gudelytė G, Navakauskienė R. Green tea polyphenol EGCG causes anti-cancerous epigenetic modulations in acute promyelocytic leukemia cells. Leuk Lymphoma. 2018 Feb;59(2):469-478.
61. Otton R, Bolin AP, Ferreira LT, Marinovic MP, Rocha ALS, Mori MA. Polyphenol-rich green tea extract improves adipose tissue metabolism by down-regulating miR-335 expression and mitigating insulin resistance and inflammation. J Nutr Biochem. 2018 Jul;57:170-179.
62. Dammann RH, Richter AM, Jiménez AP, Woods M, Küster M, Witharana C. Impact of Natural Compounds on DNA Methylation Levels of the Tumor Suppressor Gene RASSF1A in Cancer. Int J Mol Sci. 2017 Oct 17;18(10). pii: E2160.
63. Kim M, Na H, Kasai H, Kawai K, Li YS, Yang M. Comparison of Blueberry (Vaccinium spp.) and Vitamin C via Antioxidative and Epigenetic Effects in Human. J Cancer Prev. 2017 Sep;22(3):174-181
64. Herranz-López M, Olivares-Vicente M, Encinar JA, Barrajón-Catalán E, Segura-Carretero A, Joven J, Micol V. Multi-Targeted Molecular Effects of Hibiscus sabdariffa Polyphenols: An Opportunity for a Global Approach to Obesity. Nutrients. 2017 Aug 20;9(8). pii: E907. doi: 10.3390/nu9080907
65. Russo GL, Vastolo V, Ciccarelli M, Albano L, Macchia PE, Ungaro P. Dietary polyphenols and chromatin remodeling. Crit Rev Food Sci Nutr. 2017 Aug 13;57(12):2589-2599.
66. de Luca A, Hankard R, Borys JM, Sinnett D, Marcil V, Levy E. Nutriepigenomics and malnutrition. Epigenomics. 2017 Jun;9(6):893-917.
67. Russo, G. L., Russo, M., Spagnuolo, C., Tedesco, I., Bilotto, S., Iannitti, R. and Palumbo, R. Quercetin: a pleiotropic kinase inhibitor against cancer. Cancer Treatment Research 2014. 159: 185-205
68. Frolinger T, Herman F, Sharma A, Sims S, Wang J, Pasinetti GM. Epigenetic modifications by polyphenolic compounds alter gene expression in the hippocampus. Biol Open. 2018 Jul 3. pii: bio.035196
Min-Hsiung Pan, Ching-Shu Lai, Jia-Ching Wu, Chi-Tang Ho Epigenetic and Disease Targets by Polyphenols. Current Pharmaceutical Design, 2013, 19, 000-000
Рекомендуемые статьи

Стандарт организации питания в организациях образования и воспитания
На сайте "Открытые НПА" размещён проект приказа «Об утверждении Стандарта организации питания в организациях образования и воспитания». Этот документ, разработанный Казахской Академией Питания при поддержке Министерства здравоохранения, Министерства просвещения, UNICEF и WHO

«Управление здоровьем школьников г. Астана»
В 2023 году в Астане проведено масштабное исследование системы школьного питания, целью которого стало изучение текущего состояния организации питания и разработка рекомендаций для повышения качества предоставляемых услуг.

Управление здоровьем школьников г. Алматы
В 2023–2024 годах в школах города Алматы было проведено исследование системы школьного питания, организованное РОО «Национальный центр здорового питания» при поддержке Министерства просвещения и Министерства здравоохранения Казахстана.